ECF: la migliore tecnologia per il trattamento delle acque reflue
La Tecnologia ECF (ElettroCoagulazioneFlottazione)
Il processo della ElettroCoagulazioneFlottazione si basa sul trattamento elettrolitico di una soluzione acquosa, nella quale viene innescata una serie di reazioni chimiche ed elettrochimiche, associate a processi fisici in grado di favorire la trasformazione ed il successivo allontanamento dei contaminanti.
La geometria della cella e quella degli elettrodi, il loro numero, il materiale di cui sono composti e la sequenza di collocazione dipendono dalle particolari caratteristiche della soluzione da trattare e pertanto sono specificamente calcolati e progettati in accordo ad ogni singolo caso cosi come il sistema di alimentazione elettrica (RDD).
IL MECCANISMO
Il processo si sviluppa, in continuo, in una cella elettrolitica nella quale sono collocate alcune lastre di metallo fungenti da anodo e catodo e nella quale fluisce in continuo la soluzione da trattare.
I metalli impiegati per gli elettrodi sono solitamente alluminio o ferro per l’anodo (più raramente titanio o zinco) e ferro per il catodo. Gli elettrodi sono collegati ad un generatore di corrente continua con l’anodo che funge da polo positivo ed il catodo da polo negativo.
Nella cella elettrolitica, la differenza di potenziale prodotta dal generatore di corrente produce un campo elettrico.
Il passaggio della corrente elettrica provoca all’anodo la dissoluzione di parte del metallo: nel caso dell’anodo di alluminio, gli atomi del metallo passano in soluzione come ioni alluminio e si idratano. Analogamente si ossidano e passano in soluzione gli ioni ferrosi:
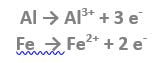
Il comportamento degli ioni alluminio e degli ioni ferrosi è molto simile, quindi da questo punto in poi assumeremo gli ioni alluminio come rappresentativi del comportamento degli ioni prodotti all’anodo (Al e/o Fe).
Il meccanismo di solvatazione non è esattamente noto in tutti i dettagli, ma il risultato finale, generalmente condiviso, è che gli ioni di Alluminio vengono circondati da un gruppo di ioni idrossile, a loro volta circondati da uno strato più esterno di molecole di acqua di solvatazione.
Questi ioni Alluminio, spinti dal campo elettrico, si muovono verso il catodo, sempre circondati dagli ioni idrossile. Questi ultimi sono invece attratti dall’anodo e saltano via in continuazione dalla nuvola elettronica di rivestimento dello ione alluminio per ‘atterrare’ su un altro ione alluminio (incontrato nel movimento verso l’anodo), essendo subito sostituiti da altri ioni idrossile provenienti dal catodo.
Questi ioni in movimento sono i trasportatori degli elettroni attraverso la soluzione e sono, in ultima analisi, i veri attori della conducibilità elettrica della soluzione.
Spesso gli ioni idrossile già presenti nell’acqua non sono sufficienti ad idratare tutti gli ioni di alluminio che vengono ossidati e che tendono a passare in soluzione. In tal caso sull’anodo si ossidano anche molecole di acqua, nelle quali gli atomi di ossigeno cedono gli elettroni all’elettrodo liberando cationi idrossonio, formano le molecole di ossigeno si sviluppano in forma di bollicine gassose:
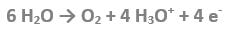
In un primo momento, le bollicine di ossigeno e gli ioni alluminio idratati ricoprono la superficie dell’anodo e, fungendo da scudo al passaggio di altri ioni idrossile (e/o di altre molecole di acqua) ostacolano il successivo dissolvimento di altri atomi di alluminio. In questo modo la reazione tenderebbe ad arrestarsi, ma dato che la tensione è sufficientemente elevata, gli atomi di alluminio e gli ioni idrossonio, seppur idratati, iniziano a muoversi verso il catodo, spinti dal campo elettrico. Altre molecole di acqua possono perciò avvicinarsi all’anodo per cedervi gli elettroni.
All’elettrodo opposto (catodo), gli elettroni resi disponibili in grandi quantità (dal generatore) vengono catturati dai cationi idrossonio nei quali l’idrogeno si riduce e si sviluppa in forma gassosa formando una barriera di bollicine adese sulla superficie del catodo. Anche in questo caso, in mancanza di H3O+, si riducono direttamente le molecole di acqua che cedono l’idrogeno contenuto liberando ioni idrossile secondo la seguente reazione:
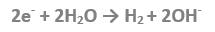
Si forma in questo modo una corrente di ioni con carica negativa che si muovono dal catodo verso l’anodo, investendo nel loro movimento tutte le sostanze contenute nella soluzione, sia quelle in soluzione (idratate), sia quelle in sospensione (solide o colloidali) sia quelle in emulsione.
Analogamente, gli atomi di alluminio idratati si muovono dall’anodo, che li genera, verso il catodo che li attrae, entrando anch’essi in contatto con tutte le varie particelle contenute nella soluzione. Anche sul catodo le bollicine prodotte creano una barriera al contatto con l’acqua e con gli ioni positivi (ioni idrossonio ed ioni metallici) e tenderebbero ad arrestare la reazione. Ma poiché la differenza di potenziale (la tensione) è sufficientemente elevata, le molecole di acqua riescono comunque a superare la parete di bollicine e raggiungono l’elettrodo ricevendone gli elettroni e liberando idrogeno gassoso e ioni idrossile. Perciò le bollicine di idrogeno coalescono crescendo in dimensione e, staccandosi dal catodo, iniziano il loro movimento verso l’alto (verso la superficie).
In una cella elettrolitica, solitamente al catodo si riducono anche gli ioni positivi, soprattutto quelli metallici (cromo esavalente, manganese, zinco, rame, etc), che, spinti dalla differenza di potenziale si muovono nella soluzione verso il catodo, sul quale si scaricano:

Nella nostra cella invece, gli atomi di metallo solvatati (cioè circondati dalla nuvola delle molecole di acqua di solvatazione), nel loro movimento verso il catodo, vengono intercettati dalle bollicine di gas prodotto sia dall’anodo (ossigeno), sia, soprattutto dal catodo (idrogeno), vengono inglobati nella schiuma e spinti verso l’alto (flottazione). Pertanto, solitamente sul catodo delle nostre celle non si depositano inquinanti.
Osserviamo che, per fare passare corrente attraverso la soluzione non è sufficiente applicare una differenza di potenziale. Quando gli elettroni si accumulano al catodo, pronti per entrare in soluzione, per viaggiare verso l’anodo devono trovare un atomo (oppure uno ione) trasportatore sul quale riescono a legarsi e sul quale vengono trasportati nella soluzione verso il catodo. Nell’acqua pura (pH=7) sia gli ioni idrossonio sia gli idrossile sono in quantità piccolissime (10 alla meno 7) e gli elettroni non trovano trasportatori, per cui la corrente non fluisce e la reazione praticamente non si sviluppa. Viceversa, nelle acque inquinate da trattare, solitamente la presenza copiosa di inquinanti fornisce quantità consistenti di ioni positivi e negativi che fungono da trasportatori per le cariche elettriche e la reazione si sviluppa con rendimenti sostenuti.
E’ infatti esperienza comune per noi che operiamo nella elettroflottazione, che in acque poco cariche di inquinanti la reazione si sviluppa con difficoltà, mentre in acque molto cariche di sostanze disciolte (cioè solvatate) la reazione procede a gonfie vele e l’allontanamento delle sostanze inquinanti risulta facilitato.
In realtà una piccola parte di elettroni fluisce comunque nella soluzione (che si comporta come un conduttore), ma questo contributo alla conducibilità elettrica è talmente piccolo da risultare, agli effetti pratici, trascurabile.
Sono quindi gli ioni, (soprattutto quelli di alluminio) che fluiscono attraverso il refluo che, investendo sia le sostanze in soluzione, sia quelle allo stato colloidale (cioè in sospensione o in emulsione), ne destabilizzano la carica superficiale avvicinandosi fino al punto in cui cominciano ad essere efficaci le forze di Van der Waals e, legandosi, creano in tal modo i coaguli. Questi iniziano poi a crescere ed a formare i fiocchi che progressivamente si compattano ed iniziano a sedimentare (precipitazione).
Il meccanismo sopra descritto non è ancora ben conosciuto e i dubbi sono ancora più d’uno. In ogni caso, è generalmente accettato che sia la destabilizzazione delle sospensioni e delle emulsioni il fattore determinante che permette la crescita dei fiocchi (floculazione) e la formazione di piccole formazioni ‘solide’ (più precisamente colloidali) dentro la soluzione.
La crescita dei fiocchi però non è tale da portare in tempi brevi a dimensioni tali da permettere una veloce decantazione (cioè separazione dei solidi dal liquido). E’ noto che, per una particella colloidale solida in sospensione in un liquido, la forza di gravità risulta spesso secondaria rispetto ad altre forze (di solvatazione, browniane, etc), a causa della ridotta dimensione.
Nel caso di una particella colloidale, pertanto, la velocità di decantazione è spesso trascurabile anche in presenza di differenze di densità considerevoli e questo porta a velocità di separazione (dei coaguli e dei fiocchi dal liquido) troppo basse ed il tempo necessario per la decantazione risulta troppo lungo ed economicamente non accettabile.
Nel caso della elettroflottazione, invece, il meccanismo di separazione (di coaguli e fiocchi) che prevale è il trascinamento verso l’alto ad opera delle bollicine di idrogeno e di ossigeno le quali, nella loro risalita, incontrano, catturano e trascinano verso la superficie tutte le micro particelle presenti nella soluzione e chiarificano pertanto, in breve tempo, l’acqua trattata.
L’azione delle bollicine di ossigeno inoltre, produce una ossidazione violenta che degrada velocemente la gran parte delle sostanze ossidabili (soprattutto organiche) riducendo il COD (e soprattutto il BOD). Uno dei fattori acceleranti è la elevatissima superficie di reazione, dato che le bollicine generate in situ (cioè quelle che si staccano dagli elettrodi) hanno dimensioni iniziali di poche decine di nanometri e la loro superficie specifica (e perciò la velocità di reazione) è milioni di volte maggiore di quella delle bollicine del diametro di un millimetro.
In conclusione, nel vano di reazione (la cella elettrolitica) si crea una corrente ascensionale di bollicine che trascinano verso l’alto gli inquinanti fino a formare una schiuma consistente, molto più compatta delle schiume che solitamente si trovano sul pelo d’acqua negli impianti di flottazione. Il gas contenuto nelle bolle (della schiuma) è inizialmente composto da ossigeno ed idrogeno. Dopo qualche minuto l’idrogeno fuoriesce (migra attraverso le pareti delle bolle della schiuma), mentre l’ossigeno rimane contenuto per alcune ore, mantenendo la schiuma galleggiante e consentendo in tal modo la separazione per sfioramento e successiva filtrazione.
In conclusione osserviamo che l’elettrolisi dell’acqua riveste un grande ruolo nel processo di elettroflottazione. Essa richiede una differenza di potenziale maggiore di quella necessaria per la dissoluzione del metallo dell’anodo, ma produce le bollicine di idrogeno e di ossigeno, necessarie sia alla flottazione (sia idrogeno che ossigeno) sia alla degradazione per ossidazione (solo ossigeno) di molti degli inquinanti contenuti nelle acque da trattare.
LE APPLICAZIONI PRATICHE
Le prime applicazioni pratiche della elettroflottazione sono state sviluppate verso la fine del 1800, ma i primi utilizzi nel trattamento (depurativo) delle acque risalgono agli anni ’90 del secolo scorso. Avevano lo scopo di eliminare dalle acque reflue i metalli e gli idrocarburi.
Oggi noi applichiamo la elettroflottazione con successo nel trattamento delle acque reflue soprattutto quando si devono abbattere i metalli pesanti, rompere le emulsioni (riducendo oli ed idrocarburi), intercettare i solidi sospesi il COD ed il BOD, oltre a ridurre in maniera spesso considerevole quasi tutti gli altri inquinanti.
Il PROGETTO DI UN IMPIANTO DI TRATTAMENTO
Durante il trattamento di elettrocoagulazione di un refluo, nella cella di reazione hanno luogo di solito molte decine, a volte centinaia, di reazioni tra loro concorrenti. Tutte queste reazioni sono in equilibrio nella (unica) fase liquida del modulo di reazione, con equilibri determinati dai rispettivi potenziali redox, dalle concentrazioni, dalla temperatura, dalle energie di attivazione, dalle sovratensioni di elettrodo, etc. La corrente fornita dal generatore (in pratica il flusso di elettroni), si divide perciò tra le varie utilizzazioni possibili (idrolisi dell’acqua, riduzione di cationi, sviluppo di ioni alluminio, etc) in funzione di tutti i parametri di reazione, che sono sempre diversi da refluo a refluo.
Perciò, quando ci si trova davanti ad un refluo da trattare con la elettroflottazione, è necessario anzitutto condurre una prima analisi della tipologia delle concentrazioni degli inquinanti da abbattere, ipotizzando le reazioni che sono prevedibili e calcolando i parametri di reazione (la corrente specifica da fornire, la tensione necessaria, il tempo di residenza, etc).
E’ bene però ammettere che non è possibile prevedere a tavolino, sulla base della sola analisi documentale, la resa all’equilibrio (delle reazioni di abbattimento, di sviluppo di ossigeno e conseguente ossidazione, etc). E’ pertanto giocoforza verificare le ipotesi con una prova pratica sperimentale.
Sulla base dei risultati sperimentali sarà possibile poi prevedere con buona approssimazione le rese di abbattimento dei vari inquinanti ottenibile con un impianto industriale di elettroflottazione per un dato refluo che si voglia trattare.


